Den første dosen surfaktant i Norge ble gitt på Rikshospitalet 1.juni 1987. Behandlingen ble først møtt med skepsis, men har sammen med økt forståelse og bruk av mer skånsomme ventilasjonsteknikker, vært viktig for å redusere mortalitet og langtidsskader hos premature. I år er det 30 år siden surfaktant ble registrert i Norge.
Tekst: Ola Didrik Saugstad, professor
Da jeg begynte ved Rikshospitalets nyfødtavdeling i 1985, var alvorlig BPD dagligdags. Pasienter lå i uker og måneder med topptrykk opp mot 50 cm H2O på respiratoren og 100% O2. I 1980 viste Fujiwara og medarbeidere, som de første i verden, at surfaktantbehandling bedret oksygeneringen hos premature med RDS (1). På dette tidspunktet var jeg et år som post doc ved nyfødtavdelingen til University of California San Diego. Avdelingen lå langt fremme i surfaktantforskning, og jeg fikk med meg forskningskappløpet som ble startet av Fujiwaras studie. Jeg lurte på hvordan vi skulle få innført vidundermidlet i Norge.

Lokalkomiteen for Curosurf-møtet i 1993 ved Soria Moria. Fra høyre: Inger Elisabeth Silberg, Morten Grønn, Ola Didrik Saugstad, Kåre Danielsen.
Den første dosen
I 1986 fikk jeg høre at de to svenskene Bengt Robertson og Tore Curstedt planla en europeisk studie med surfaktant utvunnet av griselunger (Curosurf). Med støtte fra professorene Martin Seip ved Rikshospitalet og Sverre Halvorsen ved Ullevål sykehus, spurte jeg om å få være med. Forskningsykepleier Kari Gloppestad og jeg deltok på det første Curosurf-møtet i Amsterdam i april 1986. Det var ingen kommersielle interesser involvert. Vi brukte et år på arbeidet med å få svensk surfaktant godkjent for bruk i Norge.
Den 31. mai 1987 ble det født trillinger i gestasjonsuke 29 på Rikshospitalet. Trilling 3, Anders på 1115 gram, hadde RDS og fylte inklusjonskriteriene i studien. Den ferske assistentlegen Inger Elisabeth Silberg trakk randomiseringskonvolutten: Det ble surfaktant! Vi forsto at det var et historisk øyeblikk da jeg intuberte og satte den første surfaktantdosen i Norge. Oksygeneringen bedret seg raskt. Da røntgenbildet før og etter ble demonstrert neste dag, trodde ikke radiologen det var samme pasient. De hvite lungene var blitt luftfylte på få minutter.
Norske surfaktantfunn
Snart skrev vi i «Tidsskriftet» om erfaringene med de 8 første pasientene og 6 kontroller. Fødselsvekt og gestasjonsalder var i gjennomsnitt 1215 g og 28,6 uker i surfaktantgruppen mot 1197 g og 28,8 uker i kontrollgruppen. I samsvar med de europeiske dataene (2) hvor dødeligheten ble redusert fra 51 til 31%, fant vi i vårt lille materiale en dødelighet på 50% i kontrollgruppen versus 38% i surfaktantgruppen. Tiden med behov for mer enn 40% oksygen ble redusert fra 19 dager hos kontrollene til 8,5 med surfaktant. Surfaktantpasientene fikk i snitt redusert FiO2 fra 0,91 til 0,40 i løpet av en time og videre til 0.38 etter ett døgn. Kontrollgruppen hadde en mindre endring de første 24 timene fra 0,94 til 0,82. Respiratortiden var imidlertid uendret, 16,6 versus 17,7 dager i de to gruppene (3).
Neste skritt ble å delta i en europeisk multisenter-studie der vi sammenlignet grisesurfaktant i høy og lav dose. Syv norske nyfødtavdelinger var med: Ahus, Bodø, Fredrikstad, Kristiansand, Rikshospitalet, Tønsberg og Ålesund. Selv om bare 43 norske barn ble rekruttert til studien, ble samarbeidet mellom de 7 avdelingene en viktig forløper for dagens nasjonale interessegruppe i nyfødtmedisin. Som i den europeiske hovedstudien (4) fant vi i det norske materialet ingen forskjeller i utkomme mellom høy og lavdosegruppene (5). Standarddosen av Curosurf ble derfor satt til lavdosen, 100 mg/kg. Av 8 norske inkluderte med gestasjonalder < 26 uker eller fødselsvekt < 750 gram, var alle døde etter 46 dager. Det sier mye om utviklingen i behandlingen av disse minste i løpet av de siste drøyt 30 årene.
Prinsipper for å skåne lungene
Surfaktant er ikke det eneste fremskrittet som har skjedd innen metoder for å skåne skjøre, premature lunger siden 1980-tallet. Gradvis vokste en ny forståelse av mekanismer bak lungeskade frem. Dyrestudier viste at for høye volumer bare etter få ventilasjoner kunne overstrekke lungevevet (volutraume) (6). Utilstrekkelig ventilasjon med gjentatt sammenfall og reåpning av alveoler var også skadelig (atelektotraume). Det ble klart at respiratorbehandling bidro til inflammasjon og BPD-utvikling. Fra Danmark lærte Henrik Verder oss at premature helst burde puste selv på CPAP (7).
Populasjonen av svært for tidlig fødte endret seg i løpet av 20 år, 90% eller flere fikk nå antenatale steroider. Steroidene stimulerte til økt surfaktantproduksjon, og CPAP reduserte atelektasedannelse og inflammatoriske prosesser som bryter ned surfaktant. I 2012 viste et Cochrane review at det gikk bedre med små premature hvis man lot dem puste selv på CPAP og intuberte for å gi surfaktant bare ved tegn på alvorlig respiratorisk distress (8). Dette virket nesten for fantastisk for oss som hadde jobbet med ekstreme respiratorinnstillinger!
Å intubere eller ikke intubere
Selv med antenatale steroider er surfaktantproduksjonen lav hos ekstremt premature. Mange har lurt på om det finnes måter å gi surfaktant på samtidig som man minimaliserer faren for å påføre skade ved intubasjon og respirator. Mats Blennow i Stockholm introduserte akronymet INSURE (Intubation Surfactant Extubation). For drøyt 10 år siden presenterte Angela Kribs fra Køln gode resultater med LISA metoden (Less Invasive Surfaktant Administration), der surfaktant ble gitt gjennom et kateter i trachea mens barnet pustet selv på CPAP (9,10). En fersk metanalyse viser at LISA er bedre enn INSURE (11). Men også denne metoden krever laryngoskop og er traumatisk, enten man velger å gi smertelindring eller ikke i forbindelse med prosedyren. Forstøvet surfaktant er blitt testet ut, så langt uten sikker effekt. Mer lovende er SALSA (Surfactant administration Laryngeal or Supraglottic Airways) hvor surfaktant blir administrert via larynksmaske (12).
De nyeste Europeiske retningslinjene for RDS som blir publisert i årskskiftet 2022/23 anbefaler at alle barn < 30 ukers gestasjonsalder som blir intubert for stabilisering, skal gis et naturlig surfaktant. LISA er foretrukket administrasjonsmetode for barn som puster selv på CPAP. Initialdosen av Curstedt og Robertsons grisesurfaktant er økt til 200 mg/kg. Allerede ved FiO2 over 0,3 med CPAP trykk på 6 cm H2O anbefales det å gi første dose. Dose to og eventuelt tre kan gis hvis det er et vedvarende høyt oksygenbehov når andre årsaker enn RDS er ekskludert (13).
Alternativ respirasjonsstøtte
CPAP er blitt førstevalget for respirasjonsstøtte til premature, og bør velges så sant det er mulig for barnet å puste selv. Alternative metoder for å unngå respirator prøves ut. De siste årene har utstyr for å gi synkronisert nasal intermittendede overtrykksventilering (sNIPPV) blitt tilgjengelig. Til forskjell fra konvensjonell BIPAP som har vist seg vanskelig å synkronisere med barnets respirasjon, er sNIPPV ofte effektivt for å hindre intubasjon. High flow nasal cannulae (HFNC) brukes som alternativ til CPAP. Metoden gir mindre traumer i nesen, og er godt likt av sykepleiere og foreldre da barnets ansikt blir mer synlig. HFNC gir mindre forutsigbar PEEP, og det er fortsatt omdiskutert i hvilken grad metoden kan erstatte CPAP (13).
Motstand og fremskritt
Innføringen av surfaktant ved Rikshospitalet møtte betydelig motstand. Det ble hevdet at surfaktant var farlig og kunne gi hjerneblødning. Vi ble også beskyldt for å jukse med data. Avdelingoverlegen var negativ, han mente surfaktant var for dyrt. Så sent som i 1994 skrev to kollegaer som var kritiske til innføringen av surfaktant: «Behandlingen med surfaktant er kommet for å bli. Det er imidlertid lite trolig at denne behandlingen på kort sikt vil føre til noen markert bedring i behandlingsresultatene» (14). I dag, 30 år etter surfaktant ble registrert i Norge, regner man med at 1 million dødsfall er avverget blant de 6-7 millioner nyfødte som globalt har blitt behandlet med Curstedt og Robertsons grisesurfaktant. Men historien stopper ikke her. Vi må følge med hele tiden for å få med oss nye innsikter og impulser. Bare sånn kan vi til enhver tid levere så god behandling som mulig til små premature i Norge.
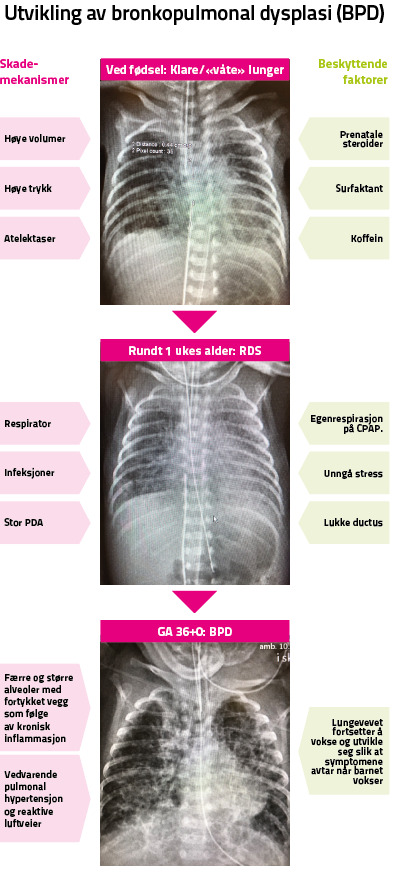
Bronkopulmonal dysplasi (BPD) er kronisk lungesykdom hos premature. Grad av prematuritet betyr mye, men de siste 30-40 årene har brakt mye ny kunnskap om hvordan behandlingen, særlig i de første minuttene, timene og dagene etter fødsel, påvirker inflammasjonsprosesser i premature lunger. Røntgenbildene viser utvikling av BPD, og er gjengitt med velvillig tillatelse fra pasientens foreldre.
Referanser:
- Fujiwara T, Maeta H, Chida S, Morita T, Watabe Y, Abe T. Artificial surfactant therapy in hyaline-membrane disease. Lancet. 1980;1(8159):55-9.
- Surfactant replacement therapy for severe neonatal respiratory distress syndrome: an international randomized clinical trial. Collaborative European Multicenter Study Group. Pediatrics. 1988;82(5):683-91
- Saugstad OD, Gloppestad K. Surfaktantbehandling av premature barn med respiratorisk distress-syndrom [Surfactant treatment of premature infants with respiratory distress syndrome]. Tidsskr Nor Laegeforen. 1990;110(29):3737-41
- Halliday HL, Tarnow-Mordi WO, Corcoran JD, Patterson CC. Multicentre randomised trial comparing high and low dose surfactant regimens for the treatment of respiratory distress syndrome (the Curosurf 4 trial). Arch Dis Child. 1993;69(3 Spec No):276-80.
- Saugstad OD, Danielsen K, Grønn M, Holt J, Meberg A, Silberg IE, Okland O. Neonatalt åndenødssyndrom behandlet med naturlig surfaktant. Den norske Curosurfstudien [Neonatal respiratory distress syndrome treated with a natural surfactant. The Norwegian Curosurf study]. Tidsskr Nor Laegeforen. 1993;113(19):2389-93.
- Björklund LJ, Ingimarsson J, Curstedt T, John J, Robertson B, Werner O, Vilstrup CT. Manual ventilation with a few large breaths at birth compromises the therapeutic effect of subsequent surfactant replacement in immature lambs. Pediatr Res. 1997;42(3):348-55.
- Verder H, Robertson B, Greisen G, Ebbesen F, Albertsen P, Lundstrøm K, Jacobsen T. Surfactant therapy and nasal continuous positive airway pressure for newborns with respiratory distress syndrome. Danish-Swedish Multicenter Study Group. N Engl J Med. 1994;331(16):1051-5.
- Bahadue FL, Soll R. Early versus delayed selective surfactant treatment for neonatal respiratory distress syndrome. Cochrane Database Syst Rev. 2012;11(11):CD001456
- Stevens TP, Harrington EW, Blennow M, Soll RF. Early surfactant administration with brief ventilation vs. selective surfactant and continued mechanical ventilation for preterm infants with or at risk for respiratory distress syndrome. Cochrane Database Syst Rev. 2007;4(4):CD003063.
- Kribs A, Pillekamp F, Hünseler C, et al.. Early administration of surfactant in spontaneous breathing with nCPAP: feasibility and outcome in extremely premature infants (postmenstrual age </=27 weeks). Paediatr Anaesth2007;17:364–9.
- Abdel-Latif ME, Davis PG, Wheeler KI, De Paoli AG, Dargaville PA. Surfactant therapy via thin catheter in preterm infants with or at risk of respiratory distress syndrome. Cochrane Database Syst Rev. 2021;5(5):CD011672.
- Roberts KD, Brown R, Lampland AL, Leone TA, Rudser KD, Finer NN, et al. Laryngeal mask airway for surfactant administration in neonates: a randomized, controlled trial. J Pediatr.2018;193:40-6.e1.
- David G Sweet, Virgilio Carnielli, Gorm Greisen,; Katrin Klebermass-Schrehof, Mikko Hallman,; Eren Ozek,; Arjan te Pas; Richard Plavka,; Charles C Roehr,; Ola D Saugstad,; Umberto Simeoni,; Christian P Speer, , Germany; Maximo Vento; Gerard HA Visser, Henry L Halliday, European Consensus Guidelines on the Management of Respiratory Distress Syndrome – 2022 Update. Neonatology in press
- Bratlid D, Farstad T. Naturlig og syntetisk surfaktant i behandling av neonatalt åndenødssyndrom [Natural and synthetic surfactant in the treatment of neonatal respiratory distress syndrome]. Tidsskr Nor Laegeforen. 1994;114(1):33-6.