Ca. 70 % av norske kvinner er cytomegalovirus (CMV) seropositive. Viruset kan detekteres i morsmelk etter fødselen på grunn av reaktivering av viruset i brystkjertlene. Barn født ekstremt prematurt som får CMV-positiv morsmelk har risiko for å utvikle CMV-infeksjon. Er morsmelk «au naturel» alltid best?
Tekst: Zarah Farnes og Kenneth Strømmen, Rikshospitalet OUS
CMV-infeksjon kan være medfødt eller ervervet. Viruset smitter via flere kroppsvæsker, deriblant morsmelk. Medfødt CMV-infeksjon er den vanligste kongenitte virusinfeksjonen med en forekomst på 0.4-0.7 % blant levendefødte i høyinntektsland (1). Infeksjonen er ofte asymptomatisk og ufarlig hos terminfødte. Median insidens av ervervet CMV-infeksjon blant premature varierer fra 6-59 % (2).
Premature barn kan smittes via morsmelk og utvikle et alvorlig sykdomsbilde. Enkelte nyfødtavdelinger har derfor valgt å tilby CMV-negativ bankmelk eller pasteurisert morsmelk til ekstremt premature født før gestasjonsuke 26, for å hindre overføring av sykdomsskapende CMV (3).
Kasuistikk 1
Mor til pasient 1 var CMV-IgG positiv og fikk en dose celeston før vaginal fødsel i gestasjonsuke (GA) 23. Barnet veide < 600 g, ble intubert, fikk Curosurf og antibiotika. Det ble startet enteral ernæring med CMV-negativ bankmelk og pasteurisert morsmelk etter avdelingens prosedyre. Barnet utviklet bronkopulmonal dysplasi (BPD) med behov for langvarig respiratorbehandling og flere steroidkurer. Pasienten var CMV-negativ i blod og spytt første leveuke. I forbindelse med tredje steroidkur, ved to måneders kronologisk alder, ble det påvist høy konsentrasjon av CMV i urin og blod, forenlig med ervervet CMV-infeksjon. Det ble gitt tre ukers intravenøs (iv) behandling med Ganciklovir, etterfulgt av peroral (po) behandling med Valganciklovir. På dette regimet sank nivåene av CMV i blodet markant (Figur 1). Etter åtte ukers behandling var CMV ikke målbart i blodet, og antiviral behandling ble seponert en måned senere. Pasienten ble i forløpet trakeostomert grunnet langvarig behov for invasiv pustestøtte (Bilde 1). Pasient 1 fikk påvist en ervervet CMV-infeksjon med ukjent smittevei. Mulige smittekilder kan være foreldre, søsken og helsepersonell. Man kan dog ikke utelukke smitte via utilsiktet tilførsel av upasteurisert/CMV-positiv morsmelk.
Kasuistikk 2
Mor til pasient 2 var også CMV-IgG positiv. Hun fikk to doser celeston før barnet ble forløst med keisersnitt i GA 24. Barnet veide < 400 g, ble intubert, fikk Curosurf, antibiotika og det ble startet enteral ernæring med upasteurisert morsmelk etter prosedyre ved lokal nyfødtavdeling. Pasienten ble ekstubert ved 4 dagers alder og mottok to steroidkurer i løpet av første fem leveuker for å unngå ny respiratorbehandling. Ved seks ukers alder ble barnet overflyttet til Rikshospitalet med mistanke om ileus. På grunn av respirasjons- og sirkulasjonssvikt ble barnet intubert og operert, der man fant to lukkede tarmperforasjoner. Postoperativt så man økende lungefortetninger (Bilde 2) og ascites. Pasienten var CMV-negativ i spytt ved fem dagers alder, men var nå CMV-positiv i blod, trakealsekret og ascitesvæske med klinisk mistanke om pneumonitt og CMV sepsis-liknende syndrom (CMV-SLS). Det ble startet iv behandling med Ganciklovir etterfulgt av po. behandling med Valganciklovir tre uker senere. På dette regimet sank nivåene av CMV i blodet markant som vist i figur 1. Etter ni dagers behandling var CMV-nivået i blodet redusert med 88 %, 99 % etter fire ukers behandling, men fortsatt målbart i blodet (Figur 1). Pasient 2 fikk påvist en ervervet CMV-infeksjon sannsynligvis forårsaket av smitte fra upasteurisert morsmelk.
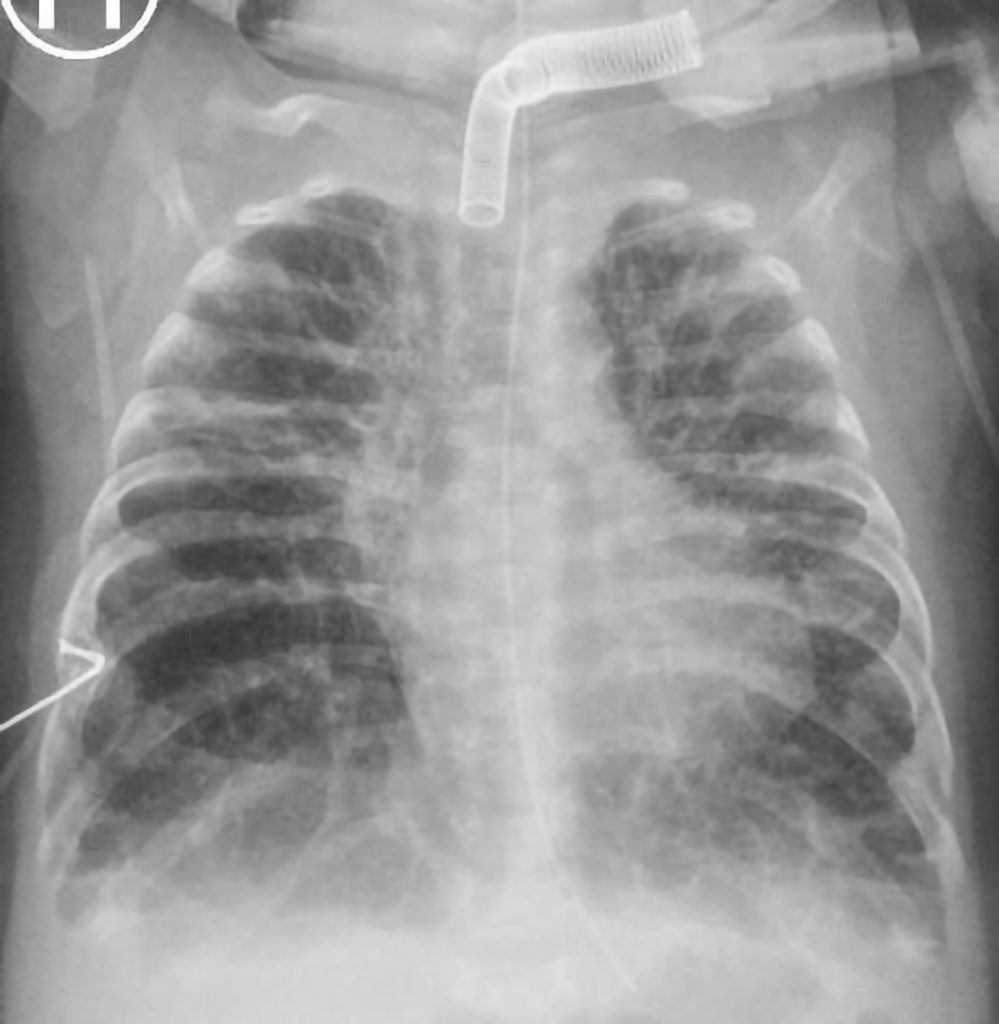
Bilde 1: Pasient 1 med trakeostomi. Grove retikulære tegninger over begge lungeflater som ved BPD.
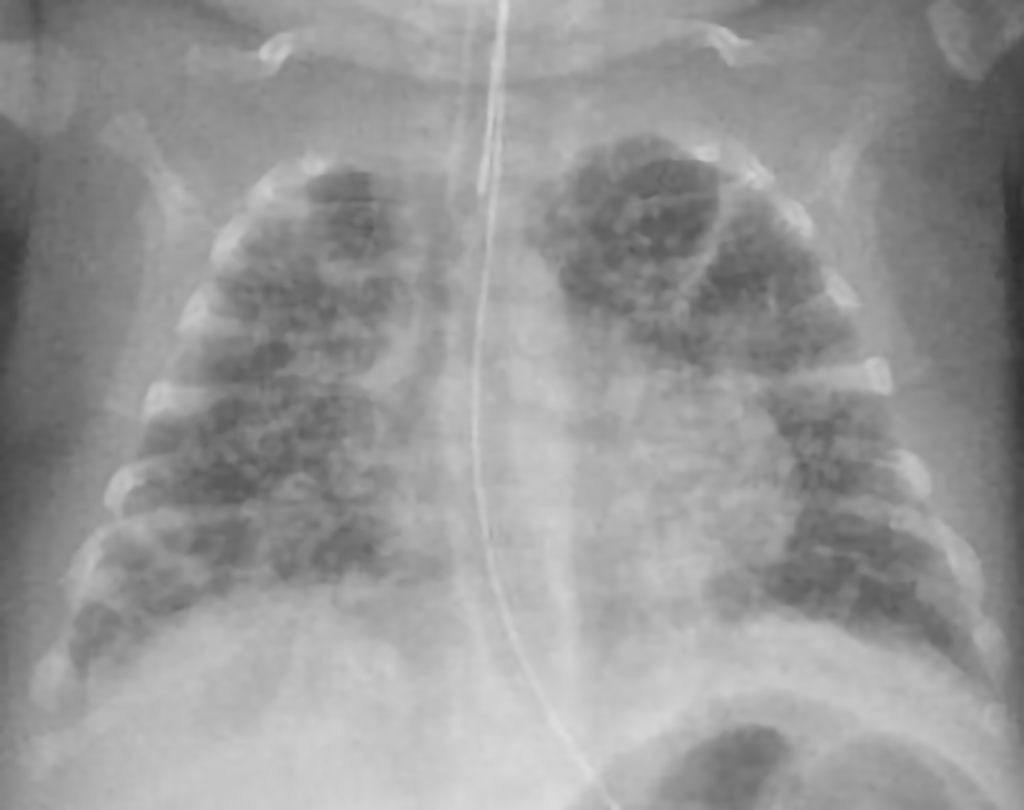
Bilde 2: Pasient 2. Intubert, flekkvise forretninger.
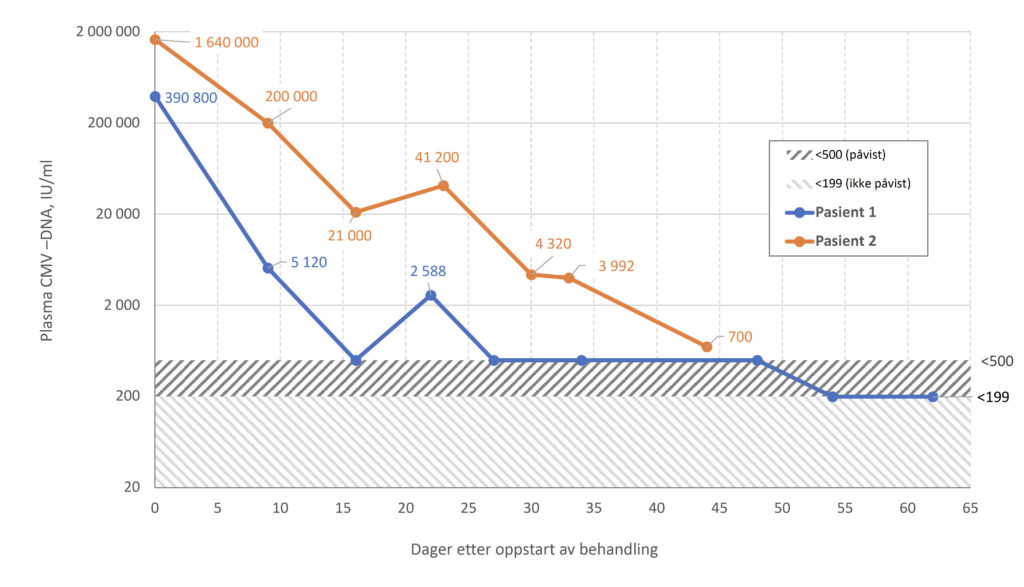
Figur 1: Plasma CMV (IU/ml) før og etter oppstart antiviral behandling hos pasient 1 og 2.
Etiologi og symptomer
Sykehistoriene er eksempler på ervervet CMV-infeksjon hos premature. Aktuelle smitteveier er kontakt med CMV-positiv livmorhals-/vaginalsekret, nærkontakt med CMV-positive familiemedlemmer, mulig helsepersonell, og via CMV-positiv morsmelk (4). I en review- og metaanalyse fant man at CMV reaktiveres hos 96 % av ammende seropositive kvinner og kan påvises i colostrum allerede tredje levedag (5). Utskillelsen av CMV i morsmelk når et toppnivå omtrent 1-2 måneder etter fødsel (4).
Symptomatisk ervervet CMV-infeksjon er uvanlig hos terminbarn, og skyldes trolig overførte maternelle antistoffer fra 3. trimester og et mer modent immunsystem (6). Lav GA ved fødsel, fødselsvekt < 1500 g, tidlig smitte og lavt IgG-nivå hos nyfødte er risikofaktorer for å utvikle sykdom (5). Premature barn, særlig de med fødselsvekt < 1500 g, har økt risiko for å utvikle symptomatisk CMV-infeksjon. De smittes mest sannsynlig via morsmelk, og kan vise tegn på infeksjon fra 3 uker til 6 måneders alder (7). Ervervet CMV-infeksjon bekreftes ved påvisning av CMV DNA PCR i urin etter 3 ukers alder, forutsatt negativ test før dette. Ved usikkerhet kan filterkortet fra nyfødtscreeningen testes for CMV, og hvis negativt styrker dette mistanken om en ervervet CMV-infeksjon (8).
Litteraturen skiller ofte mellom CMV-relaterte symptomer og CMV-SLS. CMV-relaterte symptomer inkluderer nøytropeni, trombocytopeni, petekkier, leversykdom, hyperbilirubinemi, forhøyede leverenzymer, gulsott og CMV-pneumoni. CMVSLS er CMV-infeksjon med bradykardi, apne eller respiratorisk forverring i fravær av bakteriell infeksjon. Majoriteten av nyfødte som utviklet CMV-SLS fra morsmelkassosiert CMV-infeksjon hadde debut av CMV-utskillelse i urinen før 32 uker korrigert GA (6).
Premature barn, særlig de med fødselsvekt < 1500 g, har økt risiko for å utvikle symptomatisk CMV-infeksjon.
Behandling, komplikasjoner og oppfølging
Asymptomatiske terminfødte barn med ervervet CMVinfeksjon skal vanligvis ikke behandles. Behandling kan være indisert hos premature og barn med veldig lav fødselsvekt. Det finnes ingen store studier på effekt og sikkerhet av behandling i denne pasientgruppen. Litteraturen viser til behandlingsforsøk med iv Ganciklovir eller po Valganciklovir i 4-6 uker hvor det ble observert normalisering av kliniske og hematologiske parametre (2). Målet med behandlingen var å supprimere aktiv viremi og forhindre endeorgansvikt, der behandling i over 8 uker var uvanlig (9). Pasientene omtalt i våre kasuistikker ble behandlet med iv Ganciklovir i 3 uker før overgang til po Valganciklovir, med rask reduksjon av CMV-konsentrasjon i blodet.
Nyere studier har vist at premature med lav fødselsvekt og CMV-infeksjon hadde redusert motorisk og kognitiv funksjon sammenlignet med kontrollgrupper. MR caput til prematurt fødte tenåringer som hadde ervervet CMV-infeksjon som nyfødte, viste signifikante forskjeller i utvalgte området av hjernen under utføring av språk- og visuospatiale oppgaver, samt forskjell i volum av grå substans (10). Etter disse funnene er det flere som anbefaler å forebygge ervervet CMV-infeksjon hos utvalgte pasientgrupper (4,5,10).
Premature med fødselsvekt < 1500 g som mottar CMV-positiv morsmelk har økt risiko for å utvikle nekrotiserende enterokolitt (NEC) (11). Rollen CMV-infeksjon har i utviklingen av BPD er uklar, men ved CMV-pneumoni er det ofte behov for forlenget ventilasjonsstøtte og økt oksygentilskudd, som begge er risikofaktorer for utvikling av BPD. Diffus interstitiell pneumonitt sees oftere ved ervervet CMVinfeksjon enn ved medfødt infeksjon og kan være fatalt (12). CMV-pneumonitt er sannsynligvis underdiagnostisert hos premature, som kan seile under en alvorlig BPD-diagnose i stedet. Mortaliteten ved ervervet CMV-infeksjon hos premature er lite rapportert, men omtalt i kasuistikker (13).

Illustrasjon: Carina Sanders
Konklusjon
Ervervet CMV-infeksjon kan føre til kompliserte sykehusopphold for premature barn født før GA 26/fødselsvekt < 1500 g, slik våre kasuistikker illustrerer. Ettersom en stor andel seropositive mødre skiller ut CMV i melken kan dette være et intervensjonspunkt. Det finnes flere teknikker som reduserer CMV-nivået i morsmelk. Pasteurisering med oppvarming til 62-63 °C i 30 minutter er en effektiv metode som inaktiverer CMV. Pasteurisering inaktiverer imidlertid også mange av de ønskelige komponentene i morsmelken, som laktoferrin, lysosymer, immunoglobuliner, erytropoetin, cytokiner og vekstfaktorer (10). Kortvarig pasteurisering med oppvarming til 62 °C i 5 sekunder bevarer flere av de ønskelige komponentene, i tillegg til å signifikant redusere insidensen av morsmelk-assosiert CMV-infeksjon hos premature med veldig lav fødselsvekt (14).
CMV reaktiveres hos 96% av ammende seropositive kvinner, og viruset kan påvises i colostrum allerede 3. levedag.
Alternative metoder er fryse- og strålebehandling av morsmelken. Å frysebehandle morsmelken til -20 °C over 72 timer bevarer de ønskelige komponentene og reduserer CMV-nivået signifikant (15), men ikke nok til å redusere forekomsten av CMV-smitte blant premature barn (16). Stråling av morsmelk med ultrafiolett lys i 10-50 sekunder bevarer laktoferrin, lysosymer og sekretorisk IgA, men inaktiverer ikke all CMV. Mikrobølgestråling (750 W) i 30 sekunder inaktiverer CMV fullstendig. Strålebehandling av morsmelk med ultrafiolett lys eller mikrobølger kan være lovende, men det er behov for flere studier for å undersøke hvordan disse teknikkene påvirker morsmelkens egenskaper (4,5).
Nyfødtavdelingene ved OUS har de siste årene tilbudt premature barn født GA < 26 av CMV-positive mødre pasteurisert morsmelk for å hindre overføring av CMV. Innføringen Premature barn, særlig de med fødselsvekt < 1500 g, har økt risiko for å utvikle symptomatisk CMV-infeksjon nr. 39 (3) 2021 153 av dette var basert på kliniske erfaringer og publikasjoner som beskrev økt sykelighet blant premature med ervervet CMV- infeksjon (2,5). Mødrene anmodes om blodprøve for testing av CMV-IgG. Ved positiv prøve vil foresatte informeres om risiko for overføring av viruset ved bruk av ubehandlet melk, samtidig som det informeres om effekter av pasteurisering på morsmelkens immunologiske egenskaper. Morsmelken vil pasteuriseres de ukene virusutskillelsen ansees som høy nok til å være sykdomsfremkallende, altså i 7-8 uker. Det vil samtidig tas urinprøve av barnet for CMV-testing for å utelukke medfødt infeksjon (3). De siste 5 årene har nyfødtavdelingene ved OUS hatt ca. 10 pasienter med CMV-pneumonitt, der alle var premature med BPD og klinisk forverring ved ca. 2 måneders alder. Fordi en større andel av beskyttende maternelle antistoffer er overført etter GA 28, diskuteres det om barn født tidligere bør tilbys pasteurisert morsmelk hvis mor er CMV-IgG positiv. Det er usikkert hvordan pasteurisert morsmelk påvirker barnets utvikling sammenliknet med upasteurisert morsmelk, men fordelen med å unngå ervervet CMV-infeksjon kan være verdt risikoen inntil mer informasjon foreligger.
Foreldrene har lest sitt barns sykehistorie og gitt tillatelse til at
den presenteres.
Referanser:
- Universitetssykehuset Nord-Norge. Metodebok i nyfødtmedisin, Barne- og ungdomsavdelingen. 6.utgave okt 2019, kap 4.12, 70-73.
- Gunkel J et al. Predictors of severity for postnatal cytomegalovirus infection in preterm infants and implications for treatment. Expert Rev. Anti Infect Ther. 2014;12(11):1345-55.
- Rønnestad A. CMV; Morsmelkoverført cytomegalovirus (CMV) infeksjon hos ekstremt premature barn. Prosedyre ved OUS. eHåndebok.ous-hf.no
- Bardanzellu F, Fanos V, Reali A. Human Breast Milk-Aquired Cytomegalovirus Infection: Certainties, Doubts and Perspectives. Curr Pediatr Rev. 2019, 15(1):30-41.
- Hamprecht et Goelz. Postnatal Cytomegalovirus Infection Through Human Milk in Preterm Infants/ Transmission, Clinical Presentation and Prevention. Article in press. Clin Perinatol. 2017 Mar; 44(1):121-130.
- Lanzieri TM et al. Breast Milk-Aquired Cytomegalovirus Infection and Disease in Very Low Birth Weight and Premature Infants. Pediatrics. 2013; 131(6): e1937-e1945.
- Overview of cytomegalovirus infections in children. https://www.uptodate.com/contents/overview.of.cytomegalovirus-infections-in-children
- Lopes AA, Campion V, Mitanchez D. Nutrition of Preterm Infants and Raw Breast Milk-Acquired Cytomegalovirus Infection: French National Audit of Clinical Practices and Diagnostic Approach. Nutrients 2018 Aug. 10(8):1119.
- Kadambari S, Whittaket E, Lyall H. Postnatally acquired cytomegalovirus infection in extremely premature infants: how best to manage? Archives of Disease in Childhood – Fetal and Neonatal Edition 2020;105:334-339.
- Osterholm EA, Schleiss MR. Impact of breast milk-acquired cytomegalovirus infection in premature infants: Pathogenesis, prevention, and clinical consequences? Rev Med Virol. 2020 November: 30(6): 1-11.
- Patel et al. Observational study of cytomegalovirus from breast milk and necrotising enterocolitis. Arch Dis Child Fetal Neonatal Ed 2020;105:F259-F265.
- Colite E, Di Natale C, Nigro G. Congenital and perinatal cytomegalovirus lung infection. J Matern Fetal Neonatal Med, 2013; 26(17):1671-5.
- Lopes AA, Belhabri S, Karaoui L. Clinical Findings and Autopsy of a Preterm Infant with Breast Milk-Acquired Cytomegalovirus Infection. Am J Perinatol Rep 2016;6:e198-e202.
- Bapistella et al. Short-term Pasteurization of Breast Milk to Prevent Postnatal Cytomegaloviurs Transmission in Very Preterm Infants. Clin Infec Dis. 2019 Jul 18;69(3):438-444.
- Hosseini et al. Evaluation of the Freeze-Thawing Method in Reduscing Viral Load of Cytalomegalovirus in Breast Milk of Mothers if Preterm Infants. Brestfeed Med. 2016 Dec;11:557-560.
- Omarsdottir et al. Cytomegalovirus Infection and Neonatal Outcome in Extremely Preterm Infants After Freezing of Maternal Milk. The Paediatric Infectious Disease Journal. 2015 May: 34(5):482-9.