Epilepsi rammer 0,7 % av befolkningen (1), dvs i Norge rundt 35 000 mennesker, hvorav ca 5000 er barn. Omlag 1/3 oppnår ikke anfallsfrihet ved medikamentell behandling (2), og for disse barna kan epilepsien få alvorlige følger, med redusert livskvalitet og psykomotorisk utvikling (3).
Tekst: Tale Torjussen og Kristin Alfstad, Spesialsykehuset for epilepsi-SSE, OUS
Elina trivdes og utviklet seg helt normalt frem til hun fikk sitt første epileptiske anfall ved fire måneders alder. Hun fikk så hyppige fokale anfall, med venstresidige symptomer. MR påviste en ganske stor fokal kortikal dysplasi i frontallappen på høyre side. Eline ble anfallsfri med fenobarbital. Da hun var litt over to år, fremdeles behandlet med fenobarbital, fikk hun igjen anfall, med litt annerledes utforming enn da hun var baby. Det var fremdeles symptomer pekende på anfallstart i høyre hemisfære; tilstivning i venstre arm og hode- og øyedeviasjon mot venstre. Anfallssituasjonen ble i løpet av kort tid svært alvorlig, med opptil 90 fokale anfall pr dag. MR viste uendret kortikal misdannelse i høyre frontallapp, og EEG påviste epileptisk aktivitet i høyre frontalregion, både ved anfallsstart og mellom anfall. Etter hvert fikk man delvis anfallskontroll med okskarbazepin, men ettersom Elina med høy sannsynlighet hadde en epilepsi som utgikk fra misdannelsen i høyre frontallapp ble hun operert med en frontallappsreseksjon da hun var bare litt mer enn to år gammel. Operasjonen var vellykket; hun fikk ingen følgeskade, og er blitt anfallsfri. Hun utvikler seg normalt, og har heller ikke lenger epileptisk aktivitet fra området utenom anfallstart.
Bakgrunn
Alle barn med epilepsi som ikke oppnår tilfredsstillende anfallskontroll etter forsøk med to relevante antiepileptiske legemidler, bør snarest henvises til SSE for å vurdere om epilepsikirurgi er en behandlingsmulighet. Anfallssituasjonen bør oppleves som vanskelig, slik at risikoen ved utredning og operasjon oppveies av den antatte nytten av inngrepet (4, 5). Det primære målet ved epilepsikirurgisk behandling er anfallsfrihet eller bedring i anfallssituasjonen, på sikt om mulig også seponering av antiepileptika (4, 5). Tidlig henvisning til utredning er viktig, da man i tillegg til å oppnå anfallsfrihet kan hindre stagnasjon eller tilbakegang av den psykomotoriske utviklingen, spesielt hos barn med alvorlig epileptisk encefalopati (6). Små barn har en umoden hjerne som kan formes etter erfaring, et fenomen kalt plastisitet. Dette gjør at barn oftere og raskere enn voksne restituerer/reorganiserer funksjoner som for eksempel språk etter epilepsikirurgi (3).
I Norge foregår epilepsikirurgiutredning, selve operasjonen og postoperativ oppfølging ved Spesialsykehuset for epilepsi (SSE) og Nevrokirurgisk avdeling på Rikshospitalet. Dette er en landsfunksjon da et høyspesialisert team er en forutsetning for et godt resultat (4). Den ikke-invasive utredningen finner sted under innleggelse på SSE (klinisk nevrologisk undersøkelse, kartlegging av anfallsutforming, EEG, nevroradiologi, nevropsykologi), mens invasiv utredning (intrakranielt plasserte EEG-elektroder) og det epilepsikirurgiske inngrepet utføres på Rikshospitalet. Pasientene følges med postoperative kontroller etter 3, 6, 12 og 24 måneder og etter 5 år. I årene 2012- 2015 ble det utført 113 epilepsikirurgiske inngrep i Norge, 33 av dem hos barn (egne, upubliserte tall).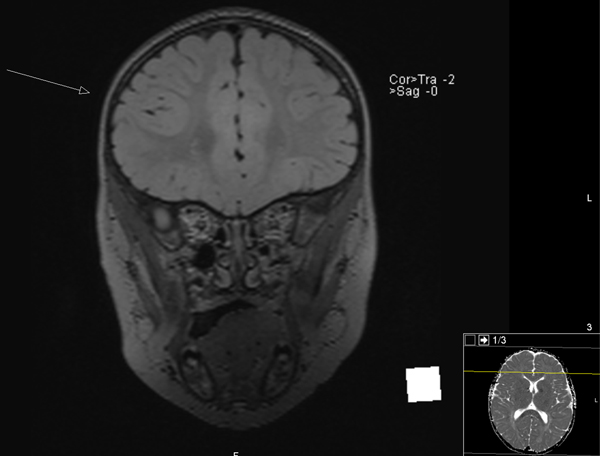
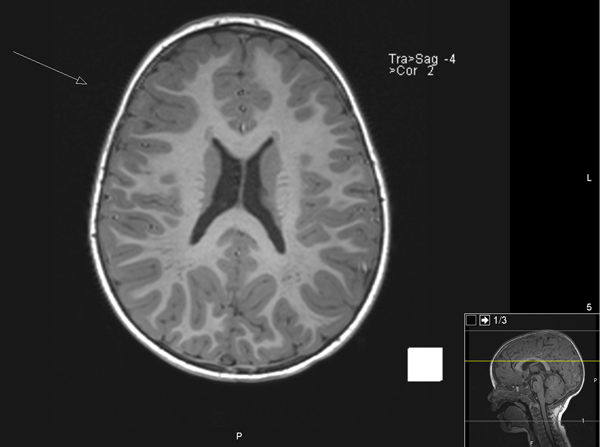
Figur 1. MR caput (coronalt og aksialt) preoperativt av 2 år gammel jente med fokal kortikal dysplasi (FCD) i hø frontallapp (markert med pil) (Bilder fra Nevroradiologisk avdeling, Rikshospitalet.)
Utredning
Som den innledende pasienthistorien illustrerer, er målet ved epilepsikirurgiutredningen å lokalisere det anfallsgivende området i hjernen så nøyaktig som mulig. Elina er et godt eksempel på at når det er konvergens mot samme hjerneområde ved de forskjellige undersøkelsene er det større sjanse for et godt resultat etter kirurgi (7).
En grundig anfallsbeskrivelse er grunnleggende, og kan gi viktig informasjon om det anfallsgivende hjerneområdet. EEG-undersøkelse, der en registrerer anfall og lokaliserer anfallsstart, er obligatorisk (4). Der man finner en epileptogen lesjon på MR er sjansen for anfallsfrihet etter operasjon god dersom lesjonen lar seg fjerne i sin helhet (8, 9). MR-undersøkelse av høy kvalitet er viktig ettersom man oppdager betydelig flere subtile epileptogene lesjoner, som kortikale dysplasier, ved å øke magnetstyrken fra 1,5 til 3 Tesla (5). Ved preoperativ nevropsykologisk undersøkelse, tilrettelagt for barn, kartlegges kognitive funksjoner som språk og hukommelse, og lokalisering av viktige funksjoner kan for større barn avklares ytterligere med fMRI (4). Dersom ikke anfallsutforming, skalp-EEG- og MR-funn gir sikker informasjon om anfallsgivende område, kan funksjonelle undersøkelser som PET, iktal SPECT eller MEG gi verdifull tilleggsinformasjon (10). Invasive EEG-registreringer, der EEG-elektroder plasseres på hjernens overflate eller i dypere hjernestrukturer, er nødvendig for noen pasienter (11).
Operasjonstyper
Hos voksne med epilepsi utgjør reseksjoner, særlig temporallappsreseksjoner, størstedelen av inngrepene (12). Barn har oftere epilepsi med utgangspunkt i andre, eller større deler av hjernebarken, eller fra hjernestrukturer som hypotalamus (11, 13, 14). Avhengig av etiologi og operasjonstype varierer antall pasienter som oppnår anfallsfrihet etter epilepsikirurgi fra under 40 til over 90 % (5).
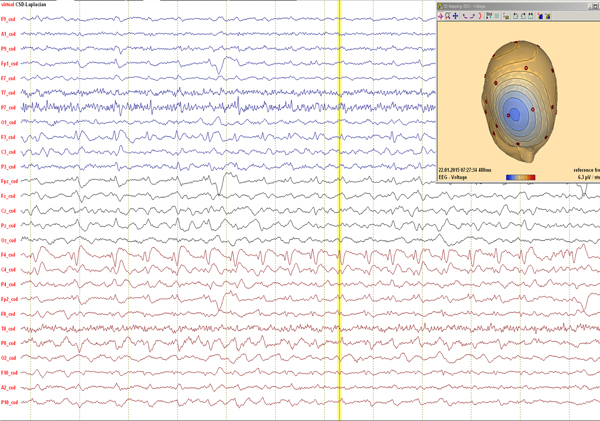
Preoperativt EEG-funn hos 2 år gammel jente. Iktal epileptiform aktivitet i frontale avledninger. (Bilder fra KNF avdeling, SSE, Hrisimir Kostov).
Reseksjon
I de tilfellene der det foreligger en antatt isolert lesjon, som i eksempelet med Elina, kan man foreta en avgrenset reseksjon. En reseksjon kan være liten eller stor, omfatte en liten del av en lapp eller flere lapper. Barn med lavgradige svulster eller vaskulære misdannelser blir oftere anfallsfrie enn de som har epilepsi på grunn av kortikale dysplasier eller sekvele etter gjennomgåtte infeksjoner eller traumer (14, 15). Også hos barn er det slik at temporallappsreseksjoner gir bedre sjanse for postoperativ anfallsfrihet enn ekstratemporale reseksjoner (14). Dette har sannsynligvis sammenheng både med etiologi og predileksjonssted for ulike strukturelle avvik. Etter temporallappsreseksjoner hos barn rapporteres det høy andel anfallsfrihet, fra 80– 91 % (3, 11). Ved ekstratemporale epilepsier er det oftere overlapping mellom epileptogen sone og viktige funksjonelle områder i cortex, slik at reseksjonene blir subtotale. Det er forbundet med dårligere postoperative resultater (11). En metaanalyse fra 2013 rapporterte om anfallsfrihet hos 56 % av barna etter ekstratemporal reseksjon (7), med bedre resultater for dem med kort sykehistorie, lesjon på MR, fokale EEG-funn og uten GTK-anfall i anamnesen.
Ved hemisfærotomi reseseres og/ eller frakobles en cerebral hemisfære. Inngrepet er aktuelt for barn med hemisfæresykdom, som i tillegg til hyppige og invalidiserende anfall ofte har hemiparese og hemianopsi preoperativt (16). Hemisfæresykdommen kan være forårsaket av perinatalt vaskulært insult eller traume, medfødt misdannelse (hemimegalencefali, Sturge-Weber syndrom) eller inflammatorisk tilstand som Rasmussens encefalitt. Resultatene fra slike inngrep er overveiende gode (17), men bedre for ervervede enn for medfødte tilstander (18).
Funksjonelle prosedyrer
De funksjonelle operasjonsprosedyrene vagusnervestimulering, callosotomi og frakobling av hypotalamushamartom er primært palliative (19). Funksjonelle prosedyrer er aktuelle der det ikke er mulig med reseksjon, enten fordi det ikke er avgrenset strukturell patologi eller strukturelle avvik er store, der reseksjon vil føre til store (eller alvorlige) sekveler, eller ved enkelte tilfeller med omfattende epileptiske nettverk.
Vagusnervestimulering (VNS) er den vanligste palliative epilepsikirurgiske prosedyren. Det er sjelden VNS-implantasjon fører til full anfallsfrihet, men mange barn kan oppnå betydelig reduksjon i anfallshyppighet (20).
Corpus callosum er hovedforbindelsen mellom de to hjernehalvdelene, og spiller en viktig rolle i spredning av epileptisk aktivitet. Callosotomi utføres hovedsakelig hos pasienter med hyppige atoniske anfall som fører til fallskader. Pasientene har ofte flere anfallstyper, og blir ikke anfallsfrie, men kan få færre atoniske anfall og GTK-anfall, og dermed mindre skader (19).
Hypotalamushamartom er en fokal, godartet svulst og kan gi farmakoresistent epilepsi med mange anfallstyper, deriblant gelastiske anfall, og store kognitive og atferdsmessige utviklingsforstyrrelser (21). Både anfallssituasjonen, kognitiv funksjon og atferd kan bedres ved å koble hamartomet fra omkringliggende strukturer ved hjelp av ulike kirurgiske teknikker (13).
For alle inngrep er den perioperative morbiditet og mortalitet lav (5), og risiko ansees å være mindre enn sykdomsbyrden som er forbundet med vedvarende ukontrollert epilepsi (22).
Oppsummering
For barn med medikamentrefraktær fokal epilepsi er epilepsikirurgi det beste behandlingsalternativet for å oppnå anfallsfrihet. Moderne utredningsmetoder har økt muligheten for nøyaktig lokalisering av epileptogen sone, og dermed for vellykket operasjonsresultat. Henvisning til utredning bør skje så raskt som mulig når medikamentell behandling ikke fører frem.
Referanser
- Syvertsen M, Nakken KO, Edland A, Hansen G, Hellum MK, Koht J. Prevalence and etiology of epilepsy in a Norwegian countyA population based study. Epilepsia. 2015;56(5):699-706.
- Kwan P, Brodie MJ. Early identification of refractory epilepsy. N Engl J Med. 2000;342(5):314-9.
- Gleissner U, Sassen R, Schramm J, Elger CE, Helmstaedter C. Greater functional recovery after temporal lobe epilepsy surgery in children. Brain. 2005;128:2822-9.
- Cross JH, Jayakar P, Nordli D, Delalande O, Duchowny M, Wieser HG, et al. Proposed criteria for referral and evaluation of children for epilepsy surgery: Recommendations of the subcommission for pediatric epilepsy surgery. Epilepsia. 2006;47(6):952-9.
- Ryvlin P, Cross JH, Rheims S. Epilepsy surgery in children and adults. Lancet Neurol. 2014;13(11):1114-26.
- Freitag H, Tuxhorn I. Cognitive function in preschool children after epilepsy surgery: Rationale for early intervention. Epilepsia. 2005;46(4):561-7.
- Englot DJ, Breshears JD, Sun PP, Chang EF, Auguste KI. Seizure outcomes after resective surgery for extra-temporal lobe epilepsy in pediatric patients A systematic review. J Neurosurg-Pediatr. 2013;12(2):126-33.
- Haneef Z, Stern J, Dewar S, Engel J. Referral pattern for epilepsy surgery after evidence-based recommendations A retrospective study. Neurology. 2010;75(8):699-704.
- McIntosh AM, Wilson SJ, Berkovic SF. Seizure outcome after temporal lobectomy: Current research practice and findings. Epilepsia. 2001;42(10):1288-307.
- Obeid M, Wyllie E, Rahi AC, Mikati MA. Approach to pediatric epilepsy surgery: State of the art, Part II: Approach to specific epilepsy syndromes and etiologies. Eur J Paediatr Neurol. 2009;13(2):115-27.
- Cossu M, Lo Russo G, Francione S, Mai R, Nobili L, Sartori I, et al. Epilepsy surgery in children: Results and predictors of outcome on seizures. Epilepsia. 2008;49(1):65-72.
- Moshe SL, Perucca E, Ryvlin P, Tomson T. Epilepsy: new advances. Lancet. 2015;385(9971):884-98.
- Procaccini E, Dorfmuller G, Fohlen M, Bulteau C, Delalande O. Surgical management of hypothalamic hamartomas with epilepsy: The stereoendoscopic approach. Neurosurgery. 2006;59(4):336-44.
- Reinholdson J, Olsson I, Edelvik A, Hallbook T, Lundgren J, Rydenhag B, et al. Long-term follow-up after epilepsy surgery in infancy and early childhood – A prospective population based observational study. Seizure-European Journal of Epilepsy. 2015;30:83-9.
- Wiebe S, Blume WT, Girvin JP, Eliasziw M, T EES. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 2001;345(5):311-8.
- Marras CE, Granata T, Franzini A, Freri E, Villani F, Casazza M, et al. Hemispherotomy and functional hemispherectomy: Indications and outcome. Epilepsy Res. 2010;89(1):104-12.
- Griessenauer CJ, Salam S, Hendrix P, Patel DM, Tubbs RS, Blount JP, et al. Hemispherectomy for treatment of refractory epilepsy in the pediatric age group: a systematic review. J Neurosurg-Pediatr. 2015;15(1):34-44.
- Hu WH, Zhang C, Zhang K, Shao XQ, Zhang JG. Hemispheric surgery for refractory epilepsy: a systematic review and meta-analysis with emphasis on seizure predictors and outcomes. J Neurosurg. 2016;124(4):952-61.
- Engel J. Approaches to refractory epilepsy. Ann Indian Acad Neur. 2014;17:S12-S7.
- Elliott RE, Rodgers SD, Bassani L, Morsi A, Geller EB, Carlson C, et al. Vagus nerve stimulation for children with treatment-resistant epilepsy: a consecutive series of 141 cases Clinical article. J Neurosurg-Pediatr. 2011;7(5):491-500.
- Mittal S, Mittal M, Montes JL, Farmer JP, Andermann F. Hypothalamic hamartomas. Part 1. Clinical, neuroimaging, and neurophysiological characteristics. Neurosurg Focus. 2013;34(6).
- Sperling MR. The consequences of uncontrolled epilepsy. Cns Spectrums. 2004;9(2):98-+.